울산의대 미생물학과 주쳘현 교수님 글.
드디어 ‘바이러스의 시간’에 관련된 마지막 글입니다. (2)부에서 예고한대로 이번 포스팅에서는 현재 본격적으로 접종이 진행되고 있는 코로나19 분자 백신들의 한계와 저항성 변이의 출현이라는 불길한 내용을 다루겠습니다. 백신 접종이 막 시작된 지금 시기에 눈치도 없이 사람들의 희망에 찬물을 끼얹는 이야기를 하기는 쉽지 않습니다. 그리고 저 역시도 이런 재수없는 예측은 틀리기를 간절히 바랍니다. 하지만 감별 진단의 가치를 잘 아는 우리 동문들은 불행의 예측이 막연한 희망보다 의료적으로 더 큰 가치가 있다는 것을 알아 주시리라 믿습니다. 비인격적인 코로나19는 사람들의 희망이나 절망에는 관심이 없습니다. 오히려 이런 불길한 경고를 꺼리는 동안 백신들에 대한 무의미한 줄 세우기나 부작용에 대한 성급하고 검증되지 않은 정보가 급속도로 퍼지면서 저항성 변이의 출현 가능성만 높아지는 안타까운 상황이 벌어지고 있습니다. 백신 저항성 변이 출현 가능성의 싹을 자르기 위해서는 지금이 가장 중요한 시기입니다. 그 이유는 다음 세 가지의 불안 요소로 나누어 설명을 드리겠습니다.
불안요소 1. 단일 단백질 항원의 백신.
코로나19에 대한 분자 백신은 빠른 개발이라는 강점과 함께 항원의 레퍼토리가 부족하다는 약점을 동시에 가지고 있습니다. (2)부에서 설명드린대로 현재 접종 중인 화이자나 아스트라제네카의 백신 모두 스파이크 단백질 하나만 면역에 항원으로 제시합니다. 물론 스파이크 단백질 항원은 항체 형성을 유도하는 면역 자극도 뛰어나고, 숙주 세포 감염 능력을 중화하는 효과도 뛰어나기 때문에 현재 코로나19의 예방이라는 일차 목표의 달성에는 충분한 역할을 합니다. 하지만 항체 저항성 변이의 발생은 이와는 완전히 다른 측면의 이야기입니다. 코로나 바이러스의 외부 막에는 스파이크 단백질 이외에도 두개의 막 단백질이 더 존재합니다. 즉 자연 상태에서 코로나19에 감염되어 면역이 획득되는 경우에는 스파이크 단백질만이 아니라 바이러스가 만들어내는 모든 외부 막의 단백질이 면역에 항원으로 제시되게 됩니다. 이 경우 스파이크 단백질에 변이가 생겨 여기에 대한 항체가 무력화되어도 다른 바이러스 단백질에 대한 항체가 보조적인 중화를 수행하여 변이의 획득을 억제하게 됩니다. 하지만 단일 단백질을 제시하는 현재의 분자 백신은 이런 다양한 항체의 억제 효과를 기대할수 없습니다. 물론 스파이크 단백질에 대해서도 한가지(monoclonal)가 아니라 다양한(polyclonal) 항체를 만들어 냅니다. 하지만 다양성면에서 자연감염에서 일어나는 변이에 저항하기에는 확률적으로 불리합니다. 간단히 정리하면 분자 백신은 설계된 기존 스파이크 항원을 가진 바이러스에 대한 보호 효과는 뛰어나지만 변이 발생에는 취약합니다.
항체만이 아니라 세포 매개 면역의 측면에서는 살펴보면 분자 백신의 취약점은 더욱 도드라집니다. 바이러스에 대한 면역에서 항체보다 더 중요한 역할을 수행하는 것이 바로 세포독성 T세포가 수행하는 세포 매개 면역입니다. 적응 면역은 항체가 주축이 되는 체액 면역과 T세포 수용체가 주축이 되는 세포 매개 면역으로 구성이 되어 있다는 것을 학부시절에 배웠던 기억이 나실 것입니다. 항체는 항원에 의해 활성화된 B세포가 형질 세포로 전환이 되면서 만들어 냅니다. 이 항체가 바이러스 입자를 열심히 중화해도 세포독성 T세포가 감염 세포를 제거하지 않으면 새로운 바이러스 입자가 계속 생성됩니다. 비유를 하자면 항체는 생성된 입자에 의한 재감염을 막는 수동적 역할을 수행하지만, 세포독성 T 세포는 바이러스 생산 공장을 선제 공격하는 능동적 역할을 수행하는 것입니다. 물론 면역의 아이콘은 항체이지만 실제는 세포 독성 T세포가 가진 면역 수용체가 더 다양한 구조를 가지고 정교한 역할을 수행합니다. 아시다시피 T 세포 수용체는 MHC class I을 통해 세포들이 제시하는 10여개의 아미노산 조각 즉 펩타이드를 검사합니다. 스파이크 단백질을 예로 들면 항체의 경우 물리적으로 3차원 구조의 외부만 인식하는 것에 비해 T 세포 수용체는 3차원 구조에 상관없이 단백질을 구성하는 펩타이드 조각들 모두를 검사하는 것입니다. 따라서 항체보다 더 정교한 인식이 가능하며 이를 통해 바이러스 감염 세포를 정확하게 찾아내고 제거하게 됩니다. 그런데 현재 분자 백신의 경우 스파이크 단백질의 펩타이드들만 T세포 수용체가 검사하게 되지만, 자연 상태의 감염에서는 바이러스가 감염 세포안에서 만들어 내는 모든 단백질에 대해 검사를 하고 기억을 획득하게 됩니다. 이것은 변이 바이러스의 출현 억제라는 관점에서 아주 중요한 차이입니다. 왜냐하면 스파이크 단백질 같은 바이러스 외부 막 단백질은 원래 변이가 빈번하지만 입자 내부의 기질 단백질과 바이러스 중합효소 단백질은 변이에 아주 취약하기 때문입니다. 즉 스파이크 단백질의 돌연 변이는 면역 회피의 기전을 제공하지만, 기질이나 중합효소 단백질의 돌연 변이는 치명적인 결과를 가져오는 경우가 대부분입니다. 따라서 자연 감염에서 T세포 수용체가 인지하는 다양한 바이러스 단백질들의 펩타이드 정보는 변이 발생을 억제하는 중요한 기전입니다. 하지만 현재의 분자 백신은 이런 다양한 바이러스 펩타이드를 제공하지 않으며, 스파이크 단백질에만 변이가 생기면 면역이 무효화될 가능성이 커지는 것입니다. 현재 새로 임상시험을 마친 노바백스의 단백질 백신은 스파이크 단백질에 기질 단백질을 같이 추가해서 접종하기에 이런 변이 발생에 대해 조금 더 안전한 것으로 평가되고 있습니다.
불안요소 2. 백신의 근육주사
두번째 불안요소는 생백신을 제외한 모든 백신은 투여 경로가 근육주사라는 것입니다. 자연상태에서 코로나 감염은 호흡기 점막을 통해 시작됩니다. 인체의 호흡기 점막은 바이러스나 세균 같은 수많은 병원체의 침입이 시작되는 면역 전쟁의 최전선이며, 이를 효율적으로 방어하기 위해 특화가 되어 있습니다. 이 방어선이 뚫리면 전신 혈관내로 병원체가 침입하게 됩니다. 이 특별한 점막의 면역은 비교적 최근에 본격적으로 연구되기 시작한 분야라 오래 전에 졸업하신 동문들은 익숙하지 않은 개념일 수 있습니다. 좌우간 호흡기 점막은 효율적인 바이러스의 면역의 시작 지점인데, 생백신의 경우는 살아있는 바이러스이기 때문에 점막에서 증식을 하면서 면역의 기억세포가 만들어지도록 유도가 가능합니다. 하지만 이외의 백신들, 특히 현재 개발되는 분자 백신들은 단백질이 아니라 유전 정보를 주입해서 항원을 제시하는 형태이기 때문에, 점막에 백신을 투여하면 항원이 발현되기도 전에 제거되어 버려 면역 획득이 잘 유도되지 않습니다. 따라서 분자 백신은 이 어려운 난관을 건너뛰고 항원이 인체의 세포에서 쉽게 발현되도록 근육주사를 하는 것입니다. 분자 백신을 접종하는 경우 심한 몸살 증상이 흔하게 동반되는 이유도 여기에 있습니다. 점막을 통하지 않고 인체 내부에 바로 항원이 노출되었기에 면역 반응이 격렬하게 일어나는 것이죠. 하지만 이는 스파이크 단백질이 제대로 발현되었으며 면역 자극이 시작되었다는 증거인 셈입니다. 그런데 이렇게 근육주사를 통해 생성되는 항체는 IgG입니다. 학부시절 항체에는 IgM, D, G, A, E의 5가지 종류(class)가 있다는 것을 배운 것을 기억하실 것입니다. 우리 몸의 면역은 정교한 기전을 통해 최초로 항원 자극이 주어진 지역에 필요한 항체를 정확하게 만들어 냅니다. 혈관내로 침투한 항원에 대해 활약하는 중화 항체는 IgG이고, 점막의 국소 방어에서 중요한 항체는 IgA입니다. 혈관내 감염이 시작되면 IgG가 전신 방어에 중요한 역할을 수행합니다. 하지만 이것은 점막으로 분비가 되지 못하기 때문에 감염 초기에 점막에서 주로 감염이 진행이 될 때에는 무용지물입니다. 점막에서 증식하는 바이러스를 중화하기 위해서는 점막으로 분비되는 IgA가 필요한데 이는 근육 주사를 통해서는 생성되지 않습니다. 우리 면역은 homing이라는 정확한 유도기전을 통해 필요한 곳에 집중적으로 항체와 세포 독성 T세포를 투입합니다. 자연 감염을 통해 점막에서 면역 자극이 시작되면 획득된 면역 세포가 점막에 상주하게 되고, 이를 통해 감염초기 단계부터 방어를 시작합니다. 하지만 백신을 통해 획득된 면역은 점막 증식 단계는 막지 못하고 전신 감염으로 확대된 단계에서부터 방어를 시작합니다. 이번에 개발된 분자 백신들의 임상시험에서 중증, 즉 폐렴으로 진행하는 것은 완벽하게 막지만 코로나19의 전파자체는 완전히 막지 못하는 결과가 나오는 이유가 여기에 있습니다. 백신의 근육주사라는 투여경로의 취약점이 무증상 전파라는 코로나19의 임상적 특성과 결합하면 코로나19 변이의 출현 확률이 올라가는 결정적인 요인이 됩니다.
불안요소 3. 코로나19의 무증상 감염
분자백신에 대한 저항성 변이 발생의 마지막 불안요소는 코로나19의 감염 특성입니다. 포스팅 (1)부에서 설명한대로 코로나19는 감염 세포에서 인터페론의 분비를 억제해 선천 면역의 시작을 늦추면서 활발히 증식합니다. 이 때문에 무증상 전파의 빈도가 높아진다고 이야기한 것을 기억하실 것입니다. 이렇게 코로나19가 선천 면역 몰래 증식을 한다는 것은 유전적 다양성 즉 여러가지 돌연 변이가 누적된다는 의미와 동일합니다. 그리고 감염이 더욱 진행되면 이 돌연 변이들에게 백신에 의해 형성된 항체들에 의한 선택압력이 가해지기 시작합니다. 자연 감염에서는 호흡기 점막에 상주하는 면역세포가 즉각 작동하기 때문에 돌연변이의 누적 속도보다 선택 압력이 더 다양하고 빠르게 전개됩니다. 하지만 불안 요소 2 에서 지적한 대로 백신에 의해 획득된 면역의 경우는 감염이 전신 혈관내로 퍼지기 전에는 면역이 없는 것과 비슷한 상태로 진행됩니다. 이런 증식과 면역 개입의 시간적 차이가 커질수록 돌연 변이가 더 많이 누적이 되고나서 면역이라는 선택압력이 가해지는 현상이 일어납니다. 즉 백신 저항성 변이의 자연 선택이 일어날 확률이 높아지는 상황이 되는 것입니다. 여기에 불안요소 1에서 지적한대로 분자 백신에 의해서는 스파이크 단백질에만 선택 압력이 가해지기 때문에 스파이크 단백질의 변이만 선택되면 현재 사용되는 모든 백신에 대한 저항성을 획득하게 되는 것입니다.
이런 백신 저항성 변이의 출현 과정은 여러분에게 익숙한 항생제 내성 세균의 출현과 같은 원리로 일어납니다. 물론 세균은 자가 증식을 하면서 내성 획득이 일어나지만 바이러스의 경우는 입자 상태가 아닌 숙주세포에서 증식을 하는 동안만 내성 획득이 일어난다는 차이는 있습니다. 모두 잘 아시다시피 내성 균주의 출현을 예방하기 위해서는 적합한 항생제를 효과가 있는 농도로 유지해야 하는 것이 기본입니다. 백신 접종도 마찬가지입니다. 현재의 분자 백신의 본질적인 취약점 때문에 집단 면역을 올리기 위해 접종하는 기간이 너무 길어지거나, 백신을 접종한 사람이 코로나19에 감염되면 내성 변이의 출현 확률이 올라갑니다. 현재의 분자백신은 발현 방법에 상관없이 모두 스파이크 단백질을 항원으로 제시합니다. 따라서 가능한 빠른 시일내에 동시접종이 이루어져야 제한적인 백신 항원에 대한 변이 발생 가능성을 최소화할 수 있습니다. 하지만 현실적으로 이 조건을 만족시킬 속도로 예방접종을 완료하는 것은 불가능합니다. 그래서 백신 접종이 시작되면서 방역이 더욱 중요한 상황이 된 것입니다. 방역으로 전파를 최소화하면서 백신 접종을 시행해 빠르게 집단 면역을 올리지 않으면 변이 발생의 위험 확률이 커지게 됩니다.
결론. 백신과 변이의 시간
방역을 강화하거나 백신 접종이 시작되면 코로나19의 재생산지수(R)는 떨어지게 됩니다. 이것은 기존의 바이러스가 통제된다는 긍정적인 신호이기도 하지만, 선택압력이 가해지고 있기 때문에 새로운 변이가 발생할 가능성이 올라간다는 위험신호이기도 합니다. 선택압력이 없는 상태에서는 저항성 변이가 도태가 되지만 선택압력이 주어지만 저항성 변이는 금방 우세종이 되기 때문입니다. 즉 백신에 의해 코로나19의 전파가 억제되는 시간은 저항성 변이라는 위험한 시도들이 진행되는 시간이기도 한 것입니다. 물론 절대세포 기생체라는 바이러스의 약점 때문에 자가 영양 생물인 세균에 비해 저항성 획득의 확률은 크지 않습니다. 하지만 현재 팬데믹 상황에서는 이런 저항성 획득 시도가 천문학적으로 일어나고 있습니다. 보통 바이러스 감염에 대해 이분법적인 생각을 하기 쉽지만, 바이러스 감염이나 변이의 발생 모두 확률적인 문제입니다. 로또 일등에 당첨될 확률은 0.00000001 (8,415,061 분의 1)로 아주 희박합니다. 그런데 무조건 일등에 당첨되는 방법이 있습니다. 숫자 5개의 모든 조합 즉 8,415,061개의 로또를 사면 됩니다 (물론 이런 짓은 아무도 하지 않겠지만요). 이처럼 확률에서 가능성이 0인 것과 희박한 것은 하늘과 땅만큼의 차이가 있습니다. 가능성이 0이면 시행횟수가 아무리 많아져도 일어나지 않지만, 아무리 희박한 확률도 시행횟수가 많아지면 언젠가는 일어나게 됩니다. 백신 저항성 변이의 발생보다 더 희박한 확률이 코로나 바이러스가 종간 장벽을 건너는 사건인데, 이미 박쥐의 SARS-CoV2가 인간으로 건너왔습니다. 희박한 확률은 0과는 다릅니다.
이렇게 한 종류의 백신에 대해 변이가 획득이 된다면 현재 개발된 백신들 대부분이 무용지물이 되어버리는 최악의 상황이 일어납니다. 그래서 백신의 종류에 상관없이 빨리 접종을 진행해 집단면역을 올려야 한다고 전문가들이 주장하는 것입니다. 그리고 저항성 변이가 발생하는 상황은 백신을 접종 받은 사람이 코로나에 감염이 될 때입니다. 이 상황이 코로나19의 저항성 변이가 선택되는 지점이기 때문에, 백신을 맞았다고 당장 마스크를 벗을 수가 없는 것입니다. 만약 제대로 된 백신 저항성 변이가 발생하면 그 개인은 중증으로 갈 위험이 커질 뿐만 아니라, 코로나21 혹은 코로나22 같은 악몽의 시작이 될 수도 있습니다. 백신 접종은 안전하고 빠르게 집단 면역을 올리는 소중한 도구이기도 하지만 본질적인 취약점이 분명히 존재합니다. 아무리 훌륭한 항생제도 잘못 사용하면 내성 균주가 출현해 무용지물이 되는 것처럼, 어렵게 개발된 소중한 백신도 반드시 제대로 사용되어야 합니다. 즉 백신은 방역의 보완제이지 대체제가 아니기 때문에, 접종과 방역은 동시에 진행되어야 합니다.
비록 제가 쓴 책의 출판을 알리기 위해 시작했지만, 세번의 포스팅을 통해 이 지긋지긋한 팬데믹의 게임 체인저는 ‘백신’이 아니라 바로 ‘우리’라는 제 마음이 전달되었다면 좋겠습니다.
긴 글 읽어 주셔서 감사드립니다.
참고문헌:
1 Domingo, E. et al. Basic concepts in RNA virus evolution. FASEB J 10, 859-864 (1996).
2 Phan, T. Genetic diversity and evolution of SARS-CoV-2. Infect Genet Evol 81, 104260 (2020).
3 Moya, A., Elena, S. F., Bracho, A., Miralles, R. & Barrio, E. The evolution of RNA viruses: A population genetics view. Proc Natl Acad Sci U S A 97, 6967-6973 (2000).
4 Antia, R., Regoes, R. R., Koella, J. C. & Bergstrom, C. T. The role of evolution in the emergence of infectious diseases. Nature 426, 658-661 (2003).
5 Cerutti, A. The regulation of IgA class switching. Nat Rev Immunol 8, 421-434 (2008).
6 Kunkel, E. J. & Butcher, E. C. Plasma-cell homing. Nat Rev Immunol 3, 822-829 (2003).
7 Ojosnegros, S. & Beerenwinkel, N. Models of RNA virus evolution and their roles in vaccine design. Immunome Res 6 Suppl 2, S5-S5 (2010).
8 Li, Q. et al. The Impact of Mutations in SARS-CoV-2 Spike on Viral Infectivity and Antigenicity. Cell 182, 1284-1294.e9 (2020).
9 Lauring, A. S. & Hodcroft, E. B. Genetic Variants of SARS-CoV-2-What Do They Mean? JAMA (2021).
10 Peiris, M. & Leung, G. M. What can we expect from first-generation COVID-19 vaccines? The Lancet 396, 1467-1469 (2020).
'두빵의 생각'에 해당되는 글 374건
- 2021.03.31 코로나19의 변이와 백신 (3)
- 2021.03.31 코로나19의 변이와 백신 (2)
- 2021.02.22 남자들이 소변볼때 뒷처리는 이렇게 하세요. 1
- 2021.02.21 대장균의 식약처 허용기준이 1000CFU/ml 인 이유와 배양검사 원리 1
울산의대 미생물학 주쳘현 교수님의 두번째 글.
이번 포스팅에서는 예고한대로 현재 실전에 투입되고 있는 아스트라제네카와 화이자 백신의 장단점을 비교해보겠습니다. 제가 아스트라제네카의 백신을 맞고 이틀 정도 몸살을 앓는 바람에 글을 올리는 것이 늦어졌습니다. 예방 접종을 받고 많은 사람들 몸살로 힘들어하고, 이를 지켜보며 예방 접종을 무서워하는 경우까지 있습니다. 하지만 현재 사용되는 코로나19 백신들의 특징을 알고 있다면 이런 몸살은 오히려 반가운 증상입니다. (1)부에서 설명했던 대로 몸살은 인터페론이 유발하기 때문입니다.
백신의 목표는 코로나19 항원에 대한 면역의 기억 세포가 만들게 하는 것입니다. 면역은 염증이라는 십자 포화를 퍼붓는 선천 면역과, 항체와 살해 세포로 바이러스를 정확하게 저격하는 적응 면역으로 구분됩니다. 바이러스가 침입하면 선천 면역이 먼저 작동해 감염이 퍼지는 것을 막는 동시에, 적응 면역을 시작하는 면역 세포들을 감염 지역으로 끌어들입니다. 유도된 적응 면역은 약 일주일 정도에 걸쳐 바이러스 항원에 결합하는 항체를 생성하는 B 세포와, 바이러스 감염 세포를 죽이는 세포 독성 T세포를 골라내서 활성화시킨 뒤 분열 증식을 유도해 바이러스를 격퇴하게 됩니다. 이 과정에서 활성화된 B세포와 T세포의 일부를 다시 잠재워서 저장하는데 이를 면역의 기억세포라고 합니다. 항체를 분비하는 세포는 바이러스가 사라지면 없어지기 시작하지만 기억세포는 몇 달에서 몇 년간 조용히 동면상태로 존재합니다. 그리다가 동일한 바이러스에 다시 감염이 되면 기억세포들이 즉시 깨어나 분열 증식하면서 항체를 분비하고 감염 세포를 죽이기 시작합니다. 따라서 코로나19에 대한 면역을 획득했다 것은 항체 생성의 단순한 의미를 넘어 기억 세포를 가지게 되었다는 것을 의미합니다. 그런데 이 정교한 적응면역은 선천면역의 염증반응 없이는 시작되지 않으며, 이 염증반응의 방아쇠 역할을 하는 것이 바로 인터페론입니다. 따라서 몸살이 난다는 것은 면역이 제대로 작동을 하고 있다는 신호인 것입니다.
현재 예방접종을 둘러싸고 부작용에 대해 많은 오해가 생기고 있습니다. 약물의 부작용은 부정적인 의미가 아니라 주된 작용(main effects)가 아닌 부가적인 작용(side effects)이라는 의미입니다. 잘 아니다시피 미녹시딜의 경우 처음에는 궤양치료제로 개발되었습니다. 하지만 혈관확장이라는 부작용이 발견되어 고혈압치료제로 사용되었습니다. 이후 다시 발모라는 부작용이 또 발견되어 최근에는 탈모 치료제로 가장 널리 사용이 됩니다. 약물의 사용목적에 따라 주작용과 부작용이 계속 변한 것입니다. 예방접종의 경우 주작용이 기억세포의 획득이라면 몸살은 그것에 동반되는 부작용(side effect)인 것이죠. 그런데 다른 치료용 약물과 조금 다르게 백신에서는 부작용이 없이 주작용이 일어나지 않습니다. 이 때문에 전통적으로 사용되는 백신에는 선천면역을 확실히 자극하기 위해 부작용, 즉 염증을 유도하는 첨가제를 넣습니다. 순차적으로 유도되는 면역반응의 특성상 백신에 대해 염증반응이 일어나지 않으면 기억세포도 안 생기기 때문입니다. 따라서 몸살이 발생했다는 것은 선천면역이 확실히 유도되었다는 반가운 신호인 것입니다. 물론 선천면역이 유도되었는데도 별 증상을 느끼지 못하는 경우가 더 많습니다. 인터페론의 분비능력이나 인터페론에 대한 전신반응의 정도가 나이와 면역 상태에 따라 개인차가 있기 때문입니다. 젊고 건강할수록 백신 접종 후 몸살이 심한 경우가 많은 이유가 여기에 있습니다.
약물에 의한 부작용 중에서 부정적인 의미를 나타내는 용어는 유해 반응 혹은 이상 반응(adverse effects)입니다. 예방접종이라는 것은 어떻게 보면 먼저 매를 맞아 둔다는 개념입니다. 당연히 나중에 맞을지도 모르는 진짜 매보다는 덜 아파야 말이 됩니다. 따라서 백신에 의한 이상반응은 코로나 직접 감염되었을 때 보다 더 위중한 증상에 해당합니다. 이상반응은 인터페론 분비와 염증 유도의 범위를 넘어서는 이상 면역 반응에 의해 일어납니다. 접종부위의 염증반응이나 경미한 몸살증상은 우리 몸에 항체를 주입하였기에 나타날 수 있는 정상 범위의 면역 반응입니다. 이것을 넘어서는 백신에 의한 단기적인 이상반응은 ‘아나필락시스’가 가장 대표적입니다. 이는 접종 후 즉시 발생하기 때문에 15 - 30분 정도 지켜봐서 아무 증상이 없으면 발생하지 않은 것입니다. 장기적 이상반응은 인체의 정상세포와 기억세포가 교차반응을 하는 경우로 ‘길렝바레’ 증후군이 가장 대표적입니다. 하지만 현재 개발되어 사용되는 코로나19 백신은 제한된 항원 단백질만 항원으로 제시하기 때문에 정상세포와의 교차반응의 발생 가능성은 희박합니다. 오히려 일반적인 코로나19 감염에 의해 십년정도 지난 뒤 발생할 가능성이 더 큽니다. 정리하면 유일하게 걱정해야 할 이상 반응은 ‘아나필락시스’이며 접종 후 30분 이내에 즉시 확인 가능합니다.
백신의 기본적인 내용은 이 정도로 마치고 현재 접종중인 백신들에 대해 구체적으로 알아보겠습니다. 이번 팬데믹에서 가장 빨리 만들어진 시노백의 백신은 전통적인 사백신입니다. 이것은 배양해서 불활성화 시킨 코로나19 바이러스 입자를 통째로 주사해서 항원으로 제시합니다. 따라서 제작은 간단하지만 안전성이나 장기적인 영향 평가에 오랜 시간이 필요합니다. 그럼에도 너무 빨리 상용화가 되었다는 불안요소가 있어 우리나라에서는 사용되지 않습니다. 최근 상용화가 된 백신들은 코로나19의 스파이크 단백질만 선택적으로 면역에 제시합니다. 코로나19 바이러스는 스파이크 단백질을 이용해 ACE2에 결합해서 숙주세포의 속으로 들어가기 때문에, 이는 중화 항체의 표적으로 가장 이상적이면서 또한 항체를 생성시키는 항원성도 뛰어나기 때문입니다. 이 스파이크 단백질을 면역에 항원으로 제시하기 위해 다양한 분자생물학적 기법을 이용하기 때문에 이들을 분자 백신이라고 통칭하기도도 합니다. 정리하면 고전적인 사백신의 항원은 바이러스 전체이고 최근 개발된 분자 백신의 항원은 스파이크 단백질 딱 하나인 것입니다.
아스트라제네카와 화이자 백신은 스파이크 단백질이 아닌 그것의 유전자를 우리 몸의 세포에 주입합니다. 이 유전자가 들어간 세포는 코로나19의 스파이크 단백질을 세포 표면에 만들어 냅니다. 우리 몸의 세포가 코로나19의 바이러스에 감염이 된 것처럼 면역을 속이는 것이죠. 그럼 면역은 스파이크 단백질에 대한 항체와 살해 세포를 만들어 내고 기억세포를 저장하게 됩니다. 여기서 어떤 방식으로 유전자를 인체의 세포에 전달하는가에 따라 재조합 바이러스 백신과 mRNA 백신이 나누어집니다. 아스트라제네카의 경우는 흔한 감기를 일으키는 아데노 바이러스의 껍질속에 코로나19의 스파이크 단백질의 DNA 유전자가 들어 있어 재조합 바이러스 백신이라 불립니다. 이에 반해 화이자 백신은 스파이크 단백질의 mRNA를 직접 투여합니다. 물론 mRNA를 그대로 투여하면 혈액내의 RNA 절단 효소에 의해 즉각 파괴가 되기 때문에 보호와 세포내 전달을 위한 물질에 결합시켜 투여를 합니다. 이런 전달 방식의 차이에 의해 백신의 안정성(stability, 안전성과 다른 말입니다)과 부작용에서 차이가 발생하게 됩니다. 하지만 면역에 제시하는 항원은 ‘거의’ 동일한 스파이크 단백질이기 때문에 백신의 주목적인 기억 세포의 획득이라는 면에서는 큰 차이가 없습니다.
아스트라제네카 방식의 장점은 훨씬 정교한 유전자 전달방식이라는 점입니다. 아데노 바이러스의 껍데기는 숙주세포에 자신의 유전자를 효율적으로 전달하기 위해 수십 억년을 진화하면서 다듬어졌기 때문입니다. 즉 가장 자연스러운 유전자의 전달방법이라는 것이죠. 여기에 바이러스라는 이름이 붙어있어 증식이 가능한 것으로 혼동하는 경우가 있는데 재조합 바이러스는 세포를 감염시켜도 증식이 불가능합니다. 아데노 껍질을 만드는 정보가 유전자에서 제거되었기 때문입니다. 즉 처음 한 번만 스파이크 단백질의 유전자를 세포 속에 집어넣으면 사라지는 것입니다. 이런 안전성을 이유로 오래전부터 유전자 치료 분야에서 활발히 연구가 되고 사용이 되어 왔던 방식입니다. 또한 백신의 DNA 유전자는 바이러스의 껍데기에 안전하게 둘러 쌓여 있어 유통 시 온도 변화에 대한 저항성도 강하다는 장점이 있습니다. 단점으로는 흔한 감기의 원인인 아데노 바이러스에 대한 항체가 있는 사람에게 접종하면 효율이 떨어질 가능성이 있다는 것입니다. 또한 세포내로 들어간 DNA는 핵까지 들어간 뒤 전사가 되어 mRNA가 만들어진 다음 스파이크 단백질이 만들어지는 과정을 거치기 때문에 발현 효율이 떨어질 가능성이 있습니다.
반대로 화이자 방식의 장점은 단순한 mRNA형태로 최종 투여되기에 빠른 개발이 가능하고, 세포내로 들어간 mRNA에서 바로 단백질이 만들어 지기 때문에 발현효율이 좋습니다. 단점으로는 mRNA의 불안정한 화학적 특성 때문에 백신 유통시에 저온을 엄격하게 유지해야 한다는 것입니다. 따라서 콜드체인이 갖춰지지 않은 개발도상국에서는 사용하기 힘든 백신입니다. 또한 유전자 발현을 위해 인체에 적용해 보는 것이 처음이라 장기적인 부작용의 데이터가 전무하다는 것도 불안 요소입니다. 코로나19 팬데믹이라는 특수성이 아니었다면 아마 mRNA 방식의 백신은 십수년은 더 있어야 임상시험이 끝날 수 있었을 것입니다. 사안의 시급성이 개발단계의 백신을 실전에 이끌어 낸 것이죠.
이렇게 비교해보면 현재 어느 백신이 더 좋은지를 따지는 것은 무의미하다는 것을 알 수 있습니다. 면역학적으로 얻는 결과는 두 백신이 동일하며 부가적인 면에서 차이가 날 뿐입니다. 초기 임상시험 결과들의 수치를 일대 일로 비교하는 보도 때문에 화이자의 백신이 성능이 더 좋은 것으로 잘못 알려졌는데 이론적으로는 차이가 날 요인이 거의 없습니다. 임상 시험에서 차이가 난 이유는 화이자의 경우는 엄밀하게 수행을 하였고 아스트라제네카의 경우는 결론을 내리지 못했기 때문입니다. 즉 더 좋고 나쁘고의 문제가 아니라 검증이 된 것과 되지 않은 것의 차이인데 이를 두백신의 우열로 받아들인 착오가 일어난 것입니다. 두 백신의 효과가 동일하다는 것은 이미 대규모의 접종이 먼저 이루어진 영국의 역학 데이터에서 쉽게 확인이 가능합니다. 또한 현재 아스트라제네카 백신의 공급이 쉬워 먼저 대량으로 접종이 되고 있기 때문에 부작용에 대한 경험이 도드라져 보이는 착시가 생기고 있습니다. 이 역시 영국의 데이터를 보면 아스트라제네카의 경우는 1차 접종에서 부작용이 심하고, 화이자는 2차 접종에서 부작용이 더 심한 것으로 보고되었습니다. 이런 현상이 생기는 이유 역시 두 백신의 유전자 전달 방식에서 기인합니다. 따라서 현재로서는 어느 것이 더 좋은 것인지 따지는 것은 무의미하고 본인이 빨리 맞을 수 있는 백신이 좋은 백신입니다.
빨리 맞는 것이 중요한 이유는 두 백신 모두 감염 시 폐렴으로 진행하는 것을 확실하게 막아 주기 때문입니다. 즉 집단 면역의 형성이라는 관점만이 아니라 자신의 안전을 위해서도 백신은 빨리 맞는 것이 현명합니다. 몸살이나 접종부위의 통증은 이상반응이 아니며 본인의 선천면역이 제대로 작동하고 있다는 증거입니다. 이런 이유로 백신 접종 후 몸살 증상을 완화하기 위해서 ‘소염’ 제인 이부브로펜 계열이 아닌 ‘해열’제인 아스트아미노펜 계열의 진통제를 권하고 있습니다. 이부브로펜의 항 염증 작용이 선천 면역을 억제하여 백신의 항체 형성 효과를 떨어트릴 가능성이 있기 때문입니다. 타이레놀 역시 증상이 나타나고 나서 복용하는 것이 권장되는데, 증상이 없는데도 미리 복용하면 백신의 효과가 떨어질 가능성이 있기 때문입니다. 물론 몸살 증상이 견디기 힘들 정도면 면역 유도가 충분하게 일어났다는 의미이기 때문에 타이레놀을 복용하지 않고 참을 필요까지는 없습니다. 이렇게 부작용을 각오하고 예방접종을 해야 하는 이유는 코로나 19가 활발히 증식을 하는 진짜 감염에서는 증상이 어디까지 진행될지 불확실하지만, 백신은 증식이 불가능한 단백질 항원만 제시하는 것이기에 초기 증상 이외에는 더 이상 진행이 되지 않기 때문입니다.
다음 마지막 포스팅에서는 (1)부와 (2)부의 내용을 종합해서 왜 전문가들이 현재 백신으로는 코로나의 전파를 막기 어렵다고 이야기하는 이유와, 백신을 무용지물로 만들 위험이 있는 저항성 변이의 출현 가능성에 대해 이야기해보겠습니다. 혹시 이글을 읽다가 생긴 궁금한 점이나, 본문 이외에도 코로나19 바이러스와 백신에 대해 궁금한 것이 있으시면 댓글로 질문해 주시면 답해드리겠습니다.
참고문헌:
1. Baden, Lindsey R., et al. "Efficacy and Safety of the Mrna-1273 Sars-Cov-2 Vaccine." New England Journal of Medicine 384.5 (2021): 403-16. Print.
2. Castells, Mariana C., and Elizabeth J. Phillips. "Maintaining Safety with Sars-Cov-2 Vaccines." New England Journal of Medicine 384.7 (2021): 643-49. Print.
3. Dan, Jennifer M., et al. "Immunological Memory to Sars-Cov-2 Assessed for up to 8 Months after Infection." Science 371.6529 (2021): eabf4063. Print.
4. Folegatti, Pedro M., et al. "Safety and Immunogenicity of the Chadox1 Ncov-19 Vaccine against Sars-Cov-2: A Preliminary Report of a Phase 1/2, Single-Blind, Randomised Controlled Trial." The Lancet 396.10249 (2020): 467-78. Print.
5. Jackson, Lisa A., et al. "An Mrna Vaccine against Sars-Cov-2 — Preliminary Report." New England Journal of Medicine 383.20 (2020): 1920-31. Print.
6. Krammer, Florian. "Sars-Cov-2 Vaccines in Development." Nature 586.7830 (2020): 516-27. Print.
7. Papageorgiou, Anastassios C., and Imran Mohsin. "The Sars-Cov-2 Spike Glycoprotein as a Drug and Vaccine Target: Structural Insights into Its Complexes with Ace2 and Antibodies." Cells 9.11 (2020): 2343. Print.
8. Russell, Raquel L., Peter Pelka, and Brian L. Mark. "Frontrunners in the Race to Develop a Sars-Cov-2 Vaccine." Canadian Journal of Microbiology 67.3 (2021): 189-212. Print.
9. Sharma, Omna, et al. "A Review of the Progress and Challenges of Developing a Vaccine for Covid-19." Frontiers in Immunology 11 (2020). Print.
10. Voysey, Merryn, et al. "Safety and Efficacy of the Chadox1 Ncov-19 Vaccine (Azd1222) against Sars-Cov-2: An Interim Analysis of Four Randomised Controlled Trials in Brazil, South Africa, and the Uk." The Lancet 397.10269 (2021): 99-111. Print.
요새 우리사회가 발전하면서 위생에 대한 개념이 많이 높아졌다. 덕분에 화장실 위생도 많이 좋아졌다. 그런데 남자들이 소변을 보고 난뒤에 바지를 올리면 요도안에 남아있던 소변이 흘러서 바지에 표시되어 난감한 경우를 경험하면, 더 열심히 소변보고 나서 뒷처리를 하는경우가 많다.
대부분은 아마도 음경끝을 손가락으로 잡고 흔들어서 남아있는 소변을 제거할려고 노력하는데, 문제는 이렇게 해도 요도 안에 남아있는 소변이 잘 안나오기도 하고, 조금 나온 소변이 화장실 주변에 다 튀어서 위생에 문제가 생긴다는 것이다. 공공시설의 화장실은 대부분 남성용 소변기인 유리널(urinal)이 설치되어 있지만, 가정집에 유리널(urinal)이 설치된 집은 아마도 거의 드물것이다. 보통 좌변기가 설치되어있는데 남자들이 소변 보고 나서 좌변기 주변으로 소변이 튀어서 위생에 문제를 일으키는 경우가 많다.
그럼 좌변기가 설치된 가정집에서는 남자들이 소변을 볼 때 뒷처리를 어떻게 하는 것이 좋을까?
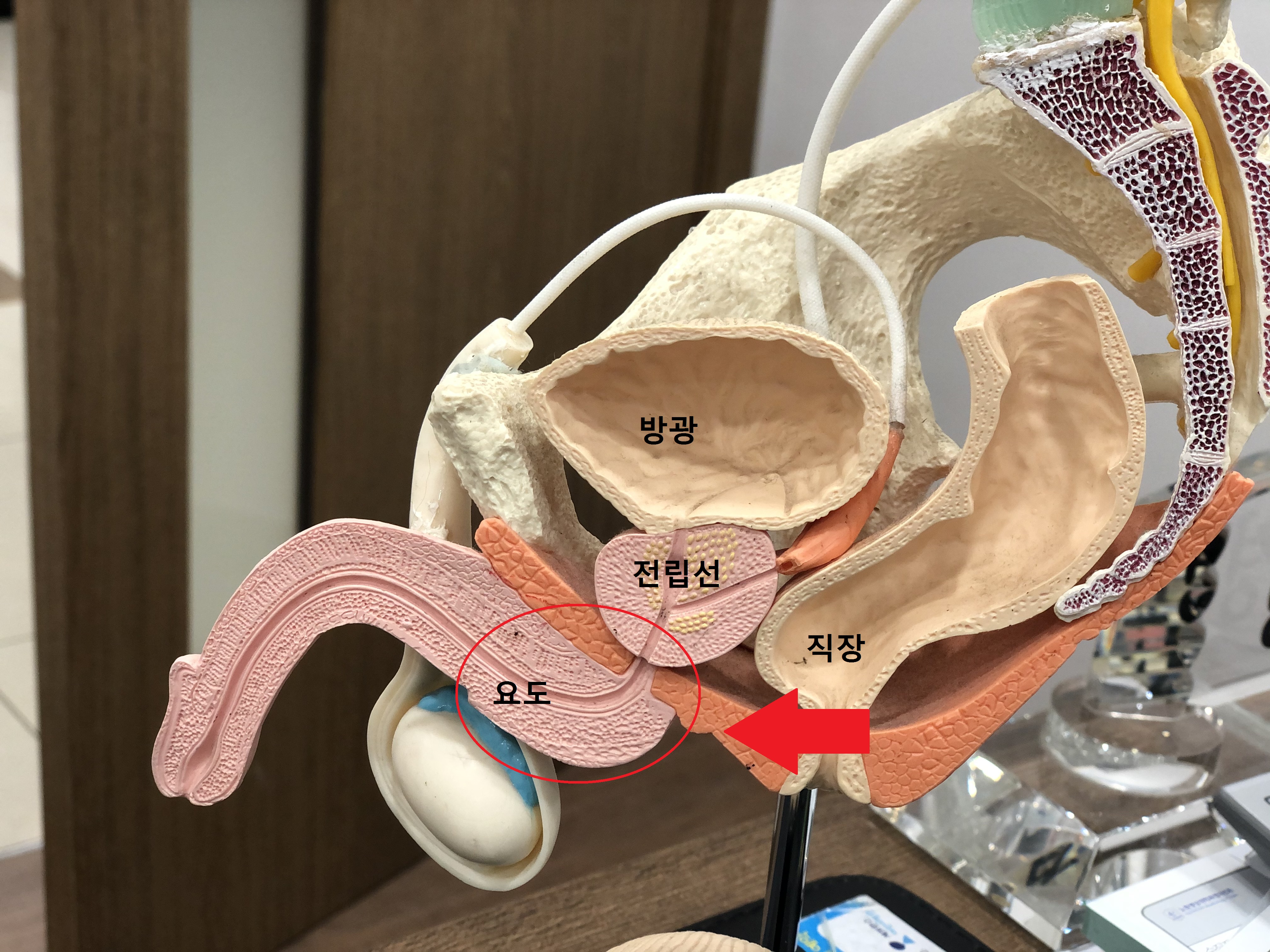
남자들이 소변을 볼 때 다 본 것 같은데 나중에 바지를 올릴 때 소변이 주루륵 나오는 이유는 여자와는 달리 남자는 요도 길이가 길고 중간이 S자로 휘어져 있어서 중력의 영향으로 위 사진의 빨간 동그라미 친 부위에 일부 소변이 남는 경우가 있다. 이 남은 소변이 나중에 바지를 올릴 때 주루륵 나오는 것이다.
이것을 아무리 손으로 털어버릴려고 음경을 잡고 흔들어봤자 체크밸브 형식으로 요도가 구부러져서 안쪽에 있는 소변이 나오는 길을 막는다. 아래 사진상의 빨대모양처럼 음경을 손으로 잡고 흔들면 요도가 꺽이면서 뒤에 남을 수밖에 없다. 쎄게 흔들수록 요도가 구부러지면서 더 막히고 일부 나온 소변은 좌변기 주변으로 엄청 튀게 된다.

화장실을 깨끗하게 하면서 요도에 남은 소변을 그래도 다 제거하는 방법은 아래 동영상처럼 하면 된다. 즉 소변을 다 본뒤에 미리 준비한 화장지를 한손에 쥐어서 요도 앞에 대고, 다른손 손가락으로 음경의 뿌리부터 앞으로 쭉 짜주면 일부 소변이 나오는데 이것을 화장지로 처리하는 것이다. 몇번 해야지 깨끗하게 처리될것이다.
처음 몇번은 할 때 좀 힘들수 있지만 익숙해지면 이렇게 안하면 오히려 더 불안하다.
물론 소변본뒤에 소변이 많이 남아서 바지를 많이 적신다면 한번쯤은 가까운 비뇨의학과 가서 다른 문제가 있는지 검사를 한번 받아보는 것이 좋겠다.
최근에 더치커피에서 오염균으로 알려져 있는 대장균(Escherichia coli, E. coli)가 많이 나와서 판매중단 뉴스가 있었다. 이 뉴스를 보니 대장균이 식약처의 허용기준이 1000 CFU/ml보다 1만4천배인 1400만CFU/ml 가 검출되었다는 이야기가 나온다.
일단 두가지가 이상하지 않은가?
첫번째로는 오염균으로 알려져 있는 대장균이 하나도 없어야 하는데 왜 식약처 허용기준은 1000 CFU/ml 미만으로 되어 있는지?
두번째로는 왜 기준이 1, 10, 51, 932 등 이런 숫자가 아니라 1000 으로 딱 떨어지는지?
이건 우리가 먹는 음식의 오염균 검사의 방법적인 한계? 때문에 저런식으로 표시하는것으로 보인다. 의학에서도 소변검사를 할 때 더치커피의 오염균 검사방법과 비슷한 방법으로 한다.
방광염등 소변에 염증이 있는지 확인을 위해서 하는 요배양검사(urine culture)를 보면,

우선 환자의 소변검체에서 루프를 사용하여 소변검체 일부를 추출하는데, 이때 채취되는 소변양이 약 0.001ml 로 되는 루프를 쓴다. (경우에 따라서는 0.01ml 루프도 있다.)
이후 0.001ml 소변이 묻은 루프를 세균배양을 하기 위한 배지 (보통은 동물의 혈액을 사용함) 에 문질러서 섭씨 35-37도에서 하루나 이틀정도 배양을 한뒤에 배양된 균의 수를 일일이 세는 방법으로 결과를 낸다.

위의 동그란 혈액배지(보통은 blood agar plate, BAP라고 함)에 세균이 자란 동그란 점을 colony forming unit, CFU 라고 이야기하는데, 보통은 이 점 하나는 균 하나에서 발생되어서 나온 것으로 생각하는 것이 타당할것이다.
그럼 0.001ml루프를 사용해서 문지른 혈액배지에 1개의 동그란 점이 생기면 1CFU 가 되고, 이건 0.001ml 에서 자란것이기 때문에 1ml는 1에 1000을 곱한 1000CFU/ml가 되는것이다.
즉 혈액배지에 세균이 하나라도 자라면 소변에 최소한 1000CFU/ml 의 세균이 있다라고 이야기할수가 있는것이다.
만일 세균이 하나도 안자라서 0 CFU가 되었다면 0 CFU/ml 가 되는게 아니라 결과는 최소한 1000CFU/ml 미만으로 있다라고 하는 것이 과학적으로 말을 할 수가 있을것이다.
이런 이유로 아마도 식약처의 오염기준이 1000CFU/ml미만이라고 한 이유는 0.001ml 루프를 사용해서 배지에 문질렀을 때 균이 자라는 점이 하나도 안생기는 기준이 1000CFU/ml 이기 때문에 1000CFU/ml 미만이라고 하면 배지에 하나도 세균이 안자랐다는 의미가 된다.
추가로 방광염의 원인균이 대장균이라고 말을 할때는 위와 같은 방법으로 배지에 100개의 세균이 자란 100CFU 이상이어야 하고, 요배양검사 결과는 >100,000 CFU/ml 라고 표시하게 된다.
위의 내용이 이해가 된다면, 만일 배양검사할 때 0.01ml 루프를 사용한다면 세균이 배지에서 1CFU가 자랐다면 이 균의 결과는 100CFU/ml 가 된다.
어렵게 돌아왔는데, 요약하면 식약처의 허용기준이 1000CFU/ml 미만이라는건 0.001 루프를 사용해서 배지에 배양했는데 균이 하나도 안나온 경우를 이야기하는것이고, 14000000CFU/ml 라는건 그 배지에서 14000 의 세균을 확인했다는 것이다. (개인적으로 14000개를 어떻게 일일이 세었는지는 좀 궁금하다.)
